Summary
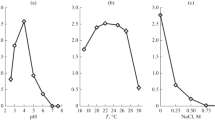
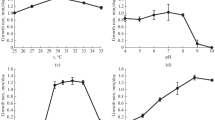
Saccharomyces rouxii is an essential micro-organism in the soy sauce/Japanese shoyu/Japanese miso fermentations. Its major activity occurs under conditions of high NaCl content, up to 18% or higher when the pH of the substrate is below 5.0.Saccharomyces rouxii grew much more rapidly and to higher cell population levels in the absence of added salt than with 18% (w/v) NaCl at either pH 7.0 or 4.5. Cells grown with 18% salt were smaller than those grown without added salt. Lower surface area combined with a thicker membrane decreased passive permeability. Growth in the presence of salt resulted in higher content of crude protein, total lipids, phosphatidyl choline and glycerol. The lipid content of the cells reflected the osmotic pressure whether it was caused by NaCl or sugar concentration in the medium. On the other hand, the cells grown in the presence of 18% NaCl contained much less K+ and retained potassium and sodium less efficiently. The triosephosphate isomerase (TPI) activity of cells grown in 18% NaCl medium was consistently higher than that of cells grown without added salt.
Résumé
Saccharomyces rouxii est un micro-organisme essentiel dans la fermentation des sauces de soja japonaises (shoyu, miso). Son activité optimale nécessite des concentrations en NaCl élevées, allant jusqu' à 18% (poids/volume), ou même davantage lorsque le pH du substrat est inférieur à 5,0. A pH 7,0 ou 4,5,S. rouxii se développe beaucoup plus rapidement et abondamment en présence qu'en l'absence de sel. Les cellules cultivées en présence de NaCl sont plus petites que celles cultivées sans sel. Du fait à la fois de leur surface moindre et de leur membrane plus épaisse, leur perméabilité passive est diminuée. Leurs teneurs en protéine brute, lipides totaux et glycérol sont sensiblement plus élevées. La teneur des cellules en lipides est déterminée par la pression osmotique, que celle-ci dépende de la concentration du milieu en NaCl ou en sucre. D'autre part, les cellules cultivées avec 18% de NaCl contiennent beaucoup moins de K+ et retiennent moins bien le potassium et le sodium que les cellules cultivées sans sel. L'activité triose-phosphate isomérase des cellules cultivées avec 18% de NaCl est supérieure à celle des cellules cultivées sans addition de sel.
Resumen
Saccharomyces rouxii es un microorganismo esencial en los procesos fermentativos japoneses shoyu miso y de obtención de salsa de soja. La parte más importante de la actividad de esta levadura se desarrolla en medios con una elevada concentración de sal (hasta más de 18%) y pH inferiores a 5.0.Saccharomyces rouxii creció más rapidamente y alcanzó concentraciones celulares mayores en un medio sin sal que en un medio con 18% de sal, tanto a pH 7.0 como a pH 4.5. Las células desarrolladas en el medio con sal fueron de tamaño inferior que las obtenidas en el medio sin sal. La menor superficie de estas últimas combinada con un mayor espesor de su membrana celular resultan en una disminución del transporte pasivo. El contenido proteíco de las células desarrolladas en el medio sin sal fue de 36.0% contra 49.5% en las células obtenidas en el medio con 18% de NaCl y 43% en células desarrolladas en medios con un contenido en sal entre 6 y 12%. Las células obtenidas en un medio sin sal retuvieron de forma similar su contenido en Na+ y K+ independientemente de la solución de lavado y de la temperatura empleadas. El contenido de Na+ fue de 0.04–0.06 mg Na/g de materia seca y el de K+ 7.78–10.04 mg K/g de materia seca. Las células desarrolladas en un medio con adición de sal contenían menor cantidad de K+ (0.48–4.77 mg/g de materia seca) variando con las condiciones de lavado. Se observó que las células obtenidas en el medio con 18% de NaCl contenían más lípidos totales (10.13%) comparadas con las células desarrolladas sin sal (6.22%). La cantidad total de fosfatidilcolina y sus liso derivados fue de 72% para las células del medio salado contra 58% en las células sin sal. El contenido lipídico de las células refleja la presión osmótica, ya sea esta producto de la concentración de NaCl o de azucar. Al incrementar el contenido en sal de el medio desde 0–6% hasta 12–18% el contenido intracelular de glicerol aumentó proporcionalmente de 0.429–1.014 hasta 1.107–1.668 mg%. El contenido en triosafosfatoisomerasa de las células crecidas en el medio con 18% NaCl fue de 66.94 unidades/mg de proteína comparado con 42.82 unidades/mg de proteína en las células obtenidas en el medio sin adición de sal.
Similar content being viewed by others
References
Anon 1980Official Methods of Analysis, 13th edn. Washington, D.C.: Association of Official Agricultural Chemists.
Beisenherz, G. 1955 Triosphosphate isomerase from calf muscle.Methods in Enzymology 1, 387–391.
Der-Feng, D. 1976 Effects of proteolipid on the physiological activities of salt-tolerant yeast.Journal of the Chinese Agricultural Chemical Society 14, 222–231.
Der-Feng, D. 1978 Relationship between lipid-protein complexes and the physiological activities of salt-tolerant yeast.Journal of the Chinese Agricultural Chemical Society 16, 111–121.
Dittmer, J.C. &Lester, R.L. 1964 A simple, specific spray for the detection of phospholipids on thin layer chromatograms.Journal of Lipid Research 5, 126–127.
Hockenhull, D.J.D. (ed.) 1973Progress in Industrial Microbiology, Vol. 12. Edinburgh & London: Churchill Livingstone.
Hunter, K. &Rose, A.H. 1971 Yeast lipids and membranes. InThe Yeasts ed. Rose, A.H. & Harrison, J.S. pp. 211–270. London: Academic Press.
Koh, T.Y. 1975 Studies on the osmophilic yeastSaccharomyces rouxii and an obligate osmophilic mutant.Journal of General Microbiology 88, 101–114.
Kolb, J.J., Weidner, M.A. &Toennies, G. 1963 Microdetermination of lipid phosphorus as a measure of bacterial membrane substance.Analytical Biochemistry,5, 78–82.
Longley, R.P., Rose, A.H. &Knights, B.A. 1968 Composition of the protoplast membrane fromSaccharomyces cerevisiae.Biochemical Journal 108, 401–412.
Lowry, O.H., Rosebrough, N.J., Farr, A.L. &Randall, R.J. 1951 Protein measurement with the Folin phenol reagent.Journal of Biological Chemistry 193, 265–275.
Mattick, L.R. &Rice, A.C. 1976 Fatty acid composition of grape seed oil from native American and hybrid grape varieties.American Journal of Enology and Viticulture 27, 88–90.
Moran, J.W. &Witter, L.D. 1979 Effect of sugars on D-arabitol production and glucose metabolism inSaccharomyces rouxii.Journal of Bacteriology 138, 823–831.
Norton, I.L., Pfuderer, P., Stringer, C.D. &Hartman, F.C. 1970 Isolation and characterization of rabbit muscle triosephosphate isomerase.Biochemistry 9, 4952–4958.
Onishi, H. 1963 Osmophilic yeasts.Advances in Food Research 12, 53–94.
Rouser, G., Kritchevsky, G. &Yamamoto, A. 1967 Column chromatographic and associated procedures for separation and determination of phosphatides and glycolipids. InLipid Chromatographic Analysis, ed. Marinetti, G.C. pp. 99–120 New York: Marcel Dekker.
Sloane, N.H. &York, J.L. 1969Review of Biochemistry. p. 137, New York: Macmillan Co.
Suomalainen, H. &Nurminen, T. 1970 The lipid composition and cell wall and plasma membrane of baker's yeast.Chemistry and Physics of Lipids 4, 247–256.
van Den Bosch, H. &van Deenen, L.L.M. 1965 Chemical structure and biochemical significance of lysolecithins from rat liver.Biochimica et Biophysica Acta 106, 326–333.
Wieland, O. 1965 Glycerol. InMethods of Enzymatic Analyses, ed. Bergmeyer, H.U. pp. 211–214. London: Academic Press.
Wells, M.A. &Dittmer, J.C. 1963 The use of Sephadex for the removal of nonlipid contaminants from lipid extracts.Biochemistry 2, 1259–1263.
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Franta, B., Steinkraus, K.H., Olek, A. et al. Some factors influencing permeability of cell walls/membranes of the osmotolerant yeastSaccharomyces rouxii grown in the presence and absence of 18% NaCl. Mircen Journal 2, 191–203 (1986). https://doi.org/10.1007/BF00937193
Received:
Revised:
Accepted:
Issue Date:
DOI: https://doi.org/10.1007/BF00937193