Summary
Hereditary deficiency of glucose phosphate isomerase (GPI) was observed in a 9-year old gire of German origin. Residual enzyme activity in red cells was 15%, in platelets 33%, and in leukocytes 35%. The patient is suffering from severe non-spherocytic haemolytic anaemia. Splenectomy did not bring about a remarkable clinical improvement.
Physico-chemical studies of the deficient enzyme showed a significantly decreased thermostability with a biphasic inactivation curve. Starch gel electrophoresis revealed only one zone of activity; the migration was 88% compared to the normal main zone. The isoelectric point was decreased (pH 9,60), determined by gel chromatography the molecular weight was within the normal range (92 000). The defect enzyme was purified from red cells 30 000-fold with a yield of 26%. The kinetic properties (Km for G-6-P, Km for F-6-P, Vmax of foreward and backward reaction, pH optimum of the foreward and backward reaction, inhibitor constants for 2.3-DPG and 6-PG of the foreward and backward reaction) were similar to those of the normal enzyme.
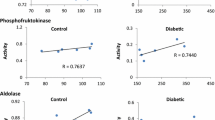
Metabolic studies demonstrated a markedly increased G-6-P concentration of the erythrocytes (90 nMol/ml RBC); ATP was slightly elevated. Lactate production from glucose was increased when compared to normal RBC and was in the normal range when compared to RBC samples with comparable content of reticulocytes.
Aging of the deficient RBC was simulated in vitro. The activity of the defect enzyme decreased slightly faster within the patient's red cells than within normal RBC during the experiment. By the 5th day of aging lactate production was only 47% compared to control cells. Simultaneously, haemolysis of 15% was observed in the deficient cells compared to only 8% in the control cell suspension. Using mannose as a source of energy bypassing the metabolic block, the rate of lactate production was still normal at the 5th day of the aging period which reflects the cause and effect relationship between impairment of energy metabolism and GPI deficiency.
Zusammenfassung
Bei einem 9jährigen Mädchen deutscher Abstammung fand sich eine hereditäre Glucosephosphat-Isomerase-Defizienz. Die Restaktivität in den Erythrocyten war 15%, in den Thrombocyten 33% und in Leukocyten 35%. Physikalisch-chemische Untersuchungen des defekten Enzyms ergaben eine stark verminderte Thermostabilität mit einer biphasischen Inaktivierungskurve. Bei der Stärkegelelektrophorese fand sich eine Bande mit einer Wanderungsgeschwindigkeit von 88% im Vergleich zur normalen Hauptbande; der isoelektrische Punkt war auf pH 9,60 erniedrigt. Das gelchromatographisch bestimmte Molekulargewicht war mit 92 000 im Normbereich. Das defekte Enzym wurde aus den Erythrocyten der Patientin mit einer Ausbeute von 26% 30 000fach angereichert. Die kinetischen Eigenschaften (Km für G-6-P, Km für F-6-P, Vmax der Vor- und Rückreaktion, pH Optimum der Vor- und Rückreaktion, sowie die Inhibitorkonstante für 2,3-DPG der Rückreaktion und die Ki für 6-PG der Vorund Rückreaktion) wichen nur unwesentlich vom Verhalten des Normalenzyms ab. Stoffwechseluntersuchungen ergaben eine Erhöhung von G-6-P auf 90 nMol/ml Erythrocyten der Patientin. ATP war leicht erhöht. Die Lactatbildung der defizienten Erythrocyten war im Vergleich zu einer Normalzell-population gesteigert und im Vergleich zu einer reticulocytenreichen Kontrolle normal.
Eine Alterung der Patientenerythrocyten in vitro ergab eine leicht beschleunigte Inaktivierung der defekten GPI in den Zellen. Die Lactatbildung sank am 5. Tag der Alterung bei Verwendung von Glucose als Energiequelle auf 47% der Kontrollzellen ab. Gleichzeitig war die Hämolyse doppelt so hoch wie bei den Kontrollzellen. Bei Verwendung von Mannose als Energiequelle, wobei der Enzymblock umgangen wird, war am 5. Tag die Lactatbildung nicht eingeschränkt. Daraus ergibt sich die Bedeutung des GPI-Defektes für die Stoffwechsel-beeinträchtigung der Erythrocyten und die Verkürzung ihrer Lebenszeit.
Similar content being viewed by others
Literatur
Arnold, H., Blume, K. G., Busch, D., Lenkeit, U., Löhr, G. W., Lübs, E.: Klinische und Biochemische Untersuchungen zur Glucosephosphat-Isomerase normaler menschlicher Erythrozyten und bei Glucosephosphat-Isomerase-Mangel. Klin. Wschr.48, 1299 (1970)
Arnold, H., Hoffmann, A., Engelhardt, R., Löhr, G. W.: Purification and kinetic properties of glucosephosphate isomerase from human erythrocytes. In: Erythrocytes, thrombocytes, leukocytes (Gerlach, Moser, Deutsch, Wilmanns, eds.). p. 177. Stuttgart: G. Thieme 1973
Arnold, H., Blume, K. G., Engelhardt, R., Löhr, G. W.: Glucosephosphate isomerase deficiency: Evidence for in vivo instability of an enzyme variant with hemolysis. Blood41, 691 (1973)
Arnold, H., Blume, K. G., Löhr, G. W., Schröter, W., Koch, H. H., Wonneberger, B.: Glucosephosphate isomerase deficiency with congenital nonspherocytic hemolytic anemia: A new variant type Nordhorn. II. Purification and biochemical properties of the defect enzyme. Pediat. Res., in press
Arnold, H., Hoffmann, A., Blume, K. G., Engelhardt, R., Löhr, G. W.: Zur Frage gewebespezifischer Isoenzyme der Glucosephosphat-Isomerase beim Menschen. Klin. Wschr. (im Druck).
Baughan, M. A., Valentine, W. N., Paglia, D. E., Ways, P. O., Simon, E. R., Demarsh, Q. B.: Hereditary anemia associated with glucosephosphate-isomerase (GPI) deficiency — A new enzyme defect of human erythrocytes. Blood30, 550 (1967)
Baughan, M. A., Valentine, W. N., Paglia, D. E., Ways, P. O., Simon, E. R., DeMarsh, Q. B.: Hereditary hemolytic anemia associated with glucosephosphate isomerase (GPI) deficiency- A new enzyme defect of human erythrocytes. Blood32, 2 (1968)
Bergmeyer, H. U.: Methoden der enzymatischen Analyse. Weinheim: Verlag Chemie 1972
Blackburn, M. N., Chirgwin, J. M., James, G. T., Kempe, T. D., Parsons, T. F., Register, A. M., Schnackerz, K. D., Noltmann, E. A.: Pseudoisoenzymes of rabbit muscle phosphoglucose isomerase. J. biol. Chem.247, 1170 (1972)
Blume, K. G., Hryniuk, W., Powars, D., Trinidad, F. West, C., Beutler, E.: Characterisation of two new variants of glucosephosphate isomerase deficiency with hereditary nonspherocytic hemolytic anemia. J. Lab. clin. Med.79, 942 (1972)
Busch, D., Pelz, A.: Erythrozytenisolierung aus Blut mit Baumwolle. Klin. Wschr.46, 983 (1966)
Cartier, P., Temkine, H., Griscelli, C.: Etude biochimique d'une anémic hémolytique avec déficit familial en phosphohexo-isomérase. 7. Intern. Congr. Clin. Chem., Genf, 1969
Dacie, J. V.: The hereditary nonspherocytic hemolytic anemias. Acta haemat. (Basel)31, 177 (1964)
Detter, J. C., Ways, P. O., Giblett, E. R., Baughan, M. A., Povey, S., Hopkinson, D. A., Harris, H.: Inherited variations in human phosphohexose isomerase. Ann. hum. Genet.32, 329 (1968)
Engelhardt, R., Arnold, H., Hoffmann, A., Jacobi, H., Löhr, G. W.: GPI-Recklinghausen: A new variant of glucosephosphate isomerase deficiency with hemolytic anemia. In: Erythrocytes, thrombocytes, leukocytes (Gerlach, Moser, Deutsch and Wilmanns) p. 180. Stuttgart: G. Thieme 1973
Kahana, S. E., Lowry, O. H., Schulz, D. W., Passonneau, J. V., Crawford, E. J.: The kinetics of phosphoglucoisomerase. J. biol. Chem.235, 2178 (1960)
Krone, W., Schneider, G., Schulz, D., Arnold, H., Blume, K. G.: Detection of phosphohexose isomerase deficiency in human fibroblast cultures. Hum. Genet.10, 224 (1970)
Leger, J., Bost, M., Colodie, L., Schaerer, R., Hollard, D.: Anémie hémolytique congenitale et familiale avec déficit en phospho-hexose-isomérase (PHI) et elliptocytose. 13. Congr. Hemat., München, 1970, Abstr. Vol. p. 293
Löhr, G. W., Waller, H. D.: Glucose-6-phosphat-Dehydrogenase (Zwischenferment). In: Bergmeyer, H. U., Methoden der enzymatischen Analyse. Weinheim, Bergstr.: Verlag Chemie 1962
Löhr, G. W., Arnold, H., Blume, K. G., Engelhardt, R., Beutler, E.: Hereditary deficiency of glucosephosphate isomerase as a cause of nonspherocytic hemolytic anemia. Blut26, 393 (1973)
Oski, F., Fuller, E.: Glucosephosphate isomerase deficiency associated with abnormal osmotic fragility and spherocytes. Clin. Res.19, 427 (1971)
Paglia, D. E., Holland, P., Baughan, M. A., Valentine, W. N.: Occurence of defective hexosephosphate isomerization in human erythrocytes and leukocytes. New Engl. J. Med.280, 66 (1969)
Parr, C. W.: Inhibition of phosphoglucose isomerase. Nature (Lond.)178, 1401 (1956)
Payne, D. M., Porter, D. W., Gracy, R. W.: Evidence against the occurence of tissue specific variants and isoenzymes of phosphoglucose isomerase. Arch. Biochem. Biophys.151, 122 (1972)
Schroeder, M., Foerster, J., Beutler, E.: Personal communication 1971
Schröter, W., Brittinger, G., Zimmerschitt, E., König, E., Schrader, D.: Combined glucosephosphate isomerase and glucose-6-phosphate dehydrogenase deficiency of the erythrocytes. Brit. J. Haemat.20, 249 (1971)
Schröter, W., Koch, H. H., Wonneberger, B., Kalinowski, W., Arnold, H., Blume, K. G., Hüther, H.: Glucosephosphate isomerase deficiency with congenital nonspherocytic hemolytic anemia: A new variant (Type Nordhorn). I. Clinical and genetic studies. Pediat. Res., in press
Slein, M. W.: Phosphohexoisomerase from muscle. In: Methods in enzymology, vol. I, p. 299. New York: Academic Press 1955
Tariverdian, G., Arnold, H., Blume, K. G., Lenkeit, U., Löhr, G. W.: Zur Formalgenetik der Glucosephosphat-Isomerase (EC: 5.3.1.9.). Humangenetik10, 218 (1970)
Valentine, W. N., Paredes, R., Paglia, D. E., Dorantes, S.: Unpublished data, 1971
Vesterberg, O., Svensson, H.: Isoelectric fractionction, analysis and characterization of ampholytes in natural pH gradients. Acta chem. scand.20, 820 (1966)
Die Autoren danken Frau K. Hasslinger und Fräulein Ch. Stach für ausgezeichnete technische Assistenz.
Author information
Authors and Affiliations
Additional information
EC 5.3.1.9.
Rights and permissions
About this article
Cite this article
Arnold, H., Engelhardt, R., Löhr, G.W. et al. Glucosephosphat-Isomerase Typ Recklinghausen: eine neue Defektvariante mit hämolytischer Anämie. Klin Wochenschr 51, 1198–1204 (1973). https://doi.org/10.1007/BF01468556
Issue Date:
DOI: https://doi.org/10.1007/BF01468556
Key words
- Glucose phosphate isomerase
- enzyme variant
- haemolytic anaemia
- biochemical properties
- red cell metabolism