Summary
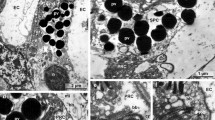
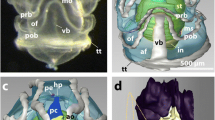
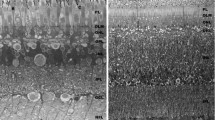
The ultrastructure of the ocelli of Lithobius forficatus L. was investigated by means of conventional electron microscopy. The dioptric apparatus consists of an unequal biconvex corneal lens which has a lamella-like fine structure. Crystalline cones and special pigment cells are lacking. The eye cup is composed of 35 to 110 sense cells of two different morphological types. The large visual cells of the distal region are characterized by unilaterally inserted rhabdomeres which form in a radial symmetrical arrangement the extended closed rhabdome. The proximal part of the eye cup is occupied by somewhat smaller basal cells of conical shape, showing an indistinct retinula. These cells have numerous microvilli either in the apex region or laterally which interdigitate to form stiltlike double or “multiple” rhabdomeres in close communication to the central rhabdome. In both types of sense cells particular zones appear because of the characteristic distribution of certain cell elements. They are arranged perpendicularly to the optical axis in the large receptors and vertical in the main axis of the basal cells. Elements of ER and other vesicles constitute a “Schaltzone” which borders the microvilli of the rhabdomer. This Schaltzone probably is a functional structure correlated to the adaptional state of the eye. The cytoplasmatic zone contains numerous different multivesicular and few large multilamellar bodies. The functional meaning of the organization of the Lithobius ocellus is discussed.
Zusammenfassung
Die Untersuchung der feinstrukturellen Organisation der Ocellen von Lithobius forficatus L. ergab, daß der dioptrische Apparat aus einer lamellenartig gebauten, ungleichseitig bikonvexen Cornealinse besteht. Ein Glaskörper und spezielle Pigmentzellen fehlen. Der Augenbecher wird von 35–110 Sinneszellen gebildet, unter denen 2 morphologisch distinkte Typen unterschieden werden können. Die großen Sehzellen des distalen Bereiches besitzen einseitig inserierende Rhabdomere, die in radiärsymmetrischer Anordnung ein umfangreiches geschlossenes Rhabdom bilden. Der proximale Teil des Augenbechers wird von kleineren, konischen Basalzellen in Form einer undeutlich abgesetzten Retinula eingenommen. Durch enge Verzahnung ihrer zirkumapikal oder zweiseitig angeordneten Mikrovilli entstehen stelzenförmige Doppel- und „Mehrfachrhabdomere“, die mit dem zentralen Rhabdom in Verbindung stehen. Alle Sehzellen sind durch eine Gliederung in verschiedene Zonen gekennzeichnet. Sie sind bei distalen Rezeptoren senkrecht zur optischen Achse, bei Basalzellen transversal zur Längsachse der Zelle angeordnet. Auf die rhabdomerischen Mikrovilli des Augenzentrums folgt nach außen eine „Schaltzone“ aus Elementen des ER und anderen vesilukären Bildungen. Diese Schaltzone stellt wahrscheinlich eine mit dem Adaptationszustand des Auges korrelierte Funktionsstruktur dar. In der cytoplasmatischen Zone fällt die Zahl verschiedenartiger multivesikulärer Korpuskel neben wenigen großen multilamellären Körpern auf. Die funktionelle Bedeutung des Ocellusaufbaus bei Lithobius wird diskutiert.
Similar content being viewed by others
Literatur
Bähr, R.: Elektrophysiologische Untersuchungen an den Ocellen von Lithobius forficatus L. Z. vergl. Physiol. 55, 70–102 (1967).
- Unveröffentlicht (1969). In Vorbereitung.
Barth, F. G.: Die Feinstruktur des Spinneninteguments. II. Die räumliche Anordnung der Mikrofasern in der lamellierten Cuticula und ihre Beziehung zur Gestalt der Porenkanäle (Cupiennius salei Keys., adult, häutungsfern, Tarsus). Z. Zellforsch. 104, 87–106 (1970).
Bedini, C.: The ultrastructure of the eye of a centipede Polybothrus fasciatus (Newport). Monit. zool. ital. 2, 31–47 (1968).
Dribakin, F. G.: Types of photoreceptor cells in the compound eye of the worker honeybee Apis mellifera as revealed by electron microscopy. Tsitologiya 9, 10, 1276–1280 (1967).
Eakin, R. M.: Evolution of photoreceptors. Cold Spr. Harb. Symp. quant. Biol. 30, 363–370 (1965).
—: Evolution of photoreceptors. Evol. Biol. Neth. 2, 194–242 (1968).
—, Brandenburger, J. L.: Differentiation in the eye of a pulmonate snail, Helix aspersa. J. Ultrastruct. Res. 18, 391–421 (1967).
Eguchi, E., Waterman, T. H.: Changes in retinal fine structure induced in the crab Libina by light and dark adaptation. Z. Zellforsch. 79, 209–229 (1967).
Ephrussi, B., Beadle, G. W.: A technic of transplantation for Drosophila. Amer. Natur. 70, 218–225 (1936).
Fahrenbach, W. H.: The morphology of the eyes of Limulus. II. Ommatidia of the compound eye. Z. Zellforsch. 93, 451–483 (1969).
Graber, V.: Über das unicorneale Tracheaten-Auge. Arch. mikr. Anat. 17, 58–93 (1880).
Grenacher, H.: Über die Augen einiger Myriapoden. Arch. mikr. Anat. 18, 415–467 (1880).
Güldner, F.-H., Wolff, J. R.: Über die Ultrastruktur des Komplexauges von Daphnia pulex. Z. Zellforsch. 104, 259–274 (1970).
Hesse, R.: Untersuchungen über die Organe der Lichtempfindung bei niederen Thieren. III. Von den Arthropoden-Augen. 2. Die Augen der Myriapoden. Z. wiss. Zool. 70, 347–473 (1901).
Horridge, G. A., Barnard, P. B. T.: Movement of palisade in locust retinula cells when illuminated. Quart. J. micr. Sci. 106, 131–135 (1965).
Huxley, H. E.: Evidence for continuity between the central elements of the triads and extracellular space in frog sartorius muscle. Nature (Lond.) 202, 1067–1071 (1964).
Joly, R.: Contribution a l'étude du cycle de mue et de son déterminisme chez les Myriapodes Chilopodes. Thèse, Fac. Sci. Université Lille (1966).
—: Sur l'ultrastructure de l'oeil de Lithobius forficatus L. (Myriapode Chilopode). C. R. Acad. Sci. (Paris) 268, 3180–3182 (1969).
—, Herbaud, C.: Sur la régénération oculaire chez Lithobius forficatus L. (Myriapode Chilopode). Arch. Zool. exp. Gen. 109, 591–612 (1968).
Kabuta, H., Tominaga, Y., Kuwabara, M.: The rhabdomeric microvilli of several arthropod compound eyes kept in darkness. Z. Zellforsch. 85, 78–88 (1968).
Kaestner, A.: Lehrbuch der Speziellen Zoologie. Teil I, 1. Aufl. Stuttgart: Gustav Fischer 1963.
Komnick, H., Wohlfarth-Bottermann, K.-E.: Morphologie des Cytoplasmas. Fortschr. Zool. 17, 1–154 (1966).
Langer, H.: Grundlagen der Wahrnehmung von Wellenlänge und Schwingungsebene des Lichtes. Verh. Dtsch. Zool. Ges., Göttingen 1966. Zool. Anz., Suppl. 30, 195–233 (1967).
Miller, W. H.: Morphology of the ommatidia of the compound eye of Limulus. J. biophys. biochem. Cytol. 3, 421–428 (1957).
Moody, M. E.: Photoreceptor organelles in animals. Biol. Rev. 39, 43–86 (1964).
Neville, A. C.: Chitin lamellogenesis in locust cuticle. Quart. J. micr. Sci. 106, 269–286 (1965a).
—: Circadian organization of chitin in some insect skeletons. Quart. J. micr. Sci. 106, 315–325 (1965b).
Nolte, A., Breucker, H., Kuhlmann, D.: Cytosomale Einschlüsse und Neurosekret im Nervengewebe von Gastropoden, Untersuchungen am Schlundring von Crepidula formicata L. (Prosobranchier, Gastropoda). Z. Zellforsch. 68, 1–27 (1965).
Paulus, H. F.: Zur Feinstruktur des zusammengesetzten Auges von Orchesella sp. (Insecta, Collembola). Z. Naturforsch. 25b, H. 3 (1970).
Perrelet, A., Baumann, F.: Evidence for extracellular space in the rhabdome of the honeybee drone eye. J. Cell Biol. 40, 825–830 (1969).
Röhlich, P., Törö, I.: Fine structure of the compound eye of Daphnia in normal, dark- and strongly light-adapted state. The structure of the eye. II. Symposium Wiesbaden, ed. J. W. Rohen, p. 175–186. Stuttgart: Schattauer 1965.
Thurm, U.: General organization of sensory receptors. R. C. Scuola Int. Fis. “E. Fermi” 43, 44–68 (1969).
- Untersuchungen zur funktionellen Organisation sensorischer Zellverbände. Verh. Dtsch. Zool. Ges., Köln 1970. Zool. Anz., Suppl. 33 (im Druck).
Varela, F. G., Porter, K. R.: Fine structure of the visual system of the honey-bee (Apis mellifera). I. The retina. J. Ultrastruct. Res. 29, 236–259 (1969).
Wachmann, E.: Multivesikuläre und andere Einschlußkörper in den Retinulazellen der Sumpfgrille Pteronemobius heydeni (Fischer). Z. Zellforsch. 99, 263–276 (1969).
Willem, V.: Les ocelles de Lithobius et de Polyxenus. Bull. Soc. malac. Belg. 27, 69–71 (1892).
Wolken, J. J.: Vision: Biophysics and Biochemistry of the retinal photoreceptors. Springfield, Ill.: Ch. C. Thomas, Publ. 1966.
Author information
Authors and Affiliations
Additional information
Mit dankenswerter Unterstützung durch die Deutsche Forschungsgemeinschaft.
Rights and permissions
About this article
Cite this article
Bähr, R. Die Ultrastruktur der Photorezeptoren von Lithobius forficatus L. (Chilopoda: Lithobiidae). Z. Zellforsch. 116, 70–93 (1971). https://doi.org/10.1007/BF00332859
Received:
Issue Date:
DOI: https://doi.org/10.1007/BF00332859