Summary
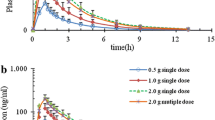
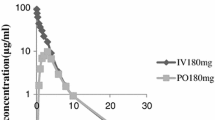
The pharmacokinetics of cefodizime (CDZ) were determined after i.v. and i.m. administration of single doses of up to 2 g and after i.v. administration of 2 g b.i.d. for six days. Serum concentrations were adequately described by three exponential functions, with a terminal half-life of about 4 h. Serum and urine levels and amounts excreted were dose-proportional, and derived pharmacokinetic characteristics were dose-independent. Steady state was established after the second dose (b.i.d.). CDZ is 100% bioavailable after i.m. administration. Concomitant administration of lidocaine did not alter either bioavailability or pharmacokinetic characteristics. Following administration of 1 and 2 g i.m., Cmax was reached after 1.2 h and amounted to 60 and 140 mg/l, respectively. CDZ is 88% bound to plasma proteins. CDZ was predominantly eliminated by the kidneys (80% of dose), a further 20% being excreted in the bile. Metabolites were not detectable in serum or urine. Dose adjustment does not seem warranted in the elderly. For renally impaired patients with CLcr between 30 and 10 ml/min, the daily dose should not exceed 2 g. For patients with CLcr below 10 ml/min, individual adjustment is suggested. CDZ showed good penetration into tissues and biological fluids (lung, bronchial secretions, pleural fluid, kidney, prostate, urine, bone, muscle, skin, Fallopian tube) with long-lasting concentrations. In urine, therapeutic concentrations were present for more than 24 h after administration of 1 and 2 g. Thus, on the basis of its pharmacokinetic profile, cefodizime is appropriate for effective treatment with once-daily administration.
Zusammenfassung
Die Pharmakokinetik von Cefodizim (CDZ) wurde nach einmaliger i.v. und i.m. Injektion von Dosen bis zu 2 g und nach sechstägiger Verabreichung von 2 × 2 g i.v. untersucht. Die Serumkonzentrationen sind durch drei Exponentialfunktionen adäquat beschrieben, die terminale Halbwertszeit beträgt vier Stunden. Serum- und Harnspiegel sowie die ausgeschiedenen Mengen waren dosis-proportional, die abgeleiteten pharmakokinetischen Charakteristika waren dosisunabhängig. Bei zweimal täglicher Verabreichung wurde bereits nach der zweiten Dosis ein Fließgleichgewicht erreicht. Die gleichzeitige Gabe von Lidocain bei i.m. Injektion hatte keinerlei Einfluß auf Bioverfügbarkeit oder pharmakokinetische Charakteristika. Nach i.m. Verabreichung von 1 bzw. 2 g wurden nach 1.2 h Maximalkonzentrationen von 60 bzw. 140 mg/l erreicht. Die Plasmaproteinbindung von CDZ beträgt 88%, die Ausscheidung erfolgt hauptsächlich über die Nieren (80% der Dosis), wobei 20% in der Gallenflüssigkeit erscheinen. Weder im Serum noch im Harn waren Metaboliten nachweisbar. Bei älteren Personen ist keine Dosisanpassung angezeigt. Bei Patienten mit eingeschränkter Nierenfunktion und einer CLcr zwischen 30 und 10 ml/min sollte die tägliche Dosis 2 g nicht überschreiten. Bei einer CLcr unter 10 ml/min ist eine individuelle Anpassung der Dosis angezeigt. CDZ penetrierte gut in Gewebe und biologische Flüssigkeiten (Lunge, Bronchialsekret, Pleuraexsudat, Niere, Prostata, Harn, Knochen, Muskel, Haut, Eileiter) und erreichte lang andauernde Konzentrationen. Im Harn bestanden nach Injektion von 1 und 2 g mehr als 24 h lang Konzentrationen im therapeutischen Bereich. Schlußfolgerung: Das pharmakokinetische Profil von CDZ ermöglicht eine wirksame antibiotische Behandlung bei einmal täglicher Verabreichung.
Similar content being viewed by others
References
Blumbach, J., Dürckheimer, W., Ehlers, E., Fleischmann, K., Klesel, N., Limbert, M., Mencke, B., Reden, J., Scheunemann, K. H., Schrinner, E., Seibert, G., Wieduwilt, M., Worm, M. Cefodizime, an aminothiazolyl cephalosporin. V. Synthesis and structure-activity relationships in the cefodizime series. J. Antibiot. 40 (1987) 29–42.
Klesel, N., Limbert, M., Seeger, K., Seibert, G., Winkler, I., Schrinner, E. Cefodizime, an aminothiazolyl cephalosporin. II. Comparative studies on the pharmacokinetic behavior in laboratory animals. J. Antibiot. 37 (1984) 901–909.
Bryskier, A., Procyk, T., Tremblay, D., Lenfant, B., Fourtillan, J. B. Pharmacokinetics of cefodizime administered intravenously as a single- dose (1.0 and 2.0 g) to healthy volunteers. J. Antimicrob. Chemother. 26 (Suppl. C) (1990) 65–70.
Bryskier, A., Procyk, T., Tremblay, D., Lenfant, B., Fourtillan, J. B. The pharmacokinetics of cefodizime following intravenous and intramuscular administration of a single dose of 1.0 g. J. Antimicrob. Chemother. 26 (Suppl. C) (1990) 59–63.
Dagrosa, E. E., Hajdú, P., Malerczyk, V., de Looze, S., Seeger, K., Grötsch, H. Dose linearity and other pharmacokinetics of cefodizime after single-dose intravenous administration. Clin. Ther. 10 (1987) 18–31.
Schäfer-Korting, M., Korting, H. C., Maaß, L., Klesel, N., Grigoleit, H.-G., Mutschler, E. Cefodizime penetration into skin suction blister fluid following a single intravenous dose. Eur. J. Clin. Pharmacol. 30 (1986) 295–298.
Hoechst AG: Cefodizime documentation. Hoechst AG, Frankfurt.
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Brockmeier, D., Dagrosa, E.E. Pharmacokinetic profile of cefodizime. Infection 20 (Suppl 1), S14–S17 (1992). https://doi.org/10.1007/BF01709944
Issue Date:
DOI: https://doi.org/10.1007/BF01709944